Relación entre temperatura y calor:
La relación es que la temperatura mide la concentración de energía o de velocidad promedio de las partículas y el calor energía térmica en transito.
Para una mejor explicación de esta relación lo mostraremos con un ejemplo: si ponemos un recipiente con agua representa la cantidad de calor que un cuerpo sede o absorbe en un instante dado, el nivel que esta alcanza representa su temperatura. Si la cantidad de agua, sube el nivel, esto es, si aumenta la cantidad de calor que posee el cuerpo, aumenta también su temperatura. Otro ejemplo se nota cuando encendemos un fósforo, se logra una alta temperatura pero bajo contenido calórico. Un a olla con 10 litros de agua tibia tiene baja temperatura y un gran contenido calórico.
Enlace: https://thales.cica.es/rd/Recursos/rd99/ed99-0265-04/calor.htm
domingo, 16 de febrero de 2020
TALLER QUÍMICA 8°
TALLER DE
REPASO
INDICACIONES: la mayoría de estos conceptos ya
han sido abordados en las clases, sin embargo falta apropiación, por ello vas a
leer el documento y: copiar palabras claves (las que consideres más importantes),
vas también a copiar los conceptos que te falten, por ejemplo si no tienes el
concepto de ion, pues lo copias.
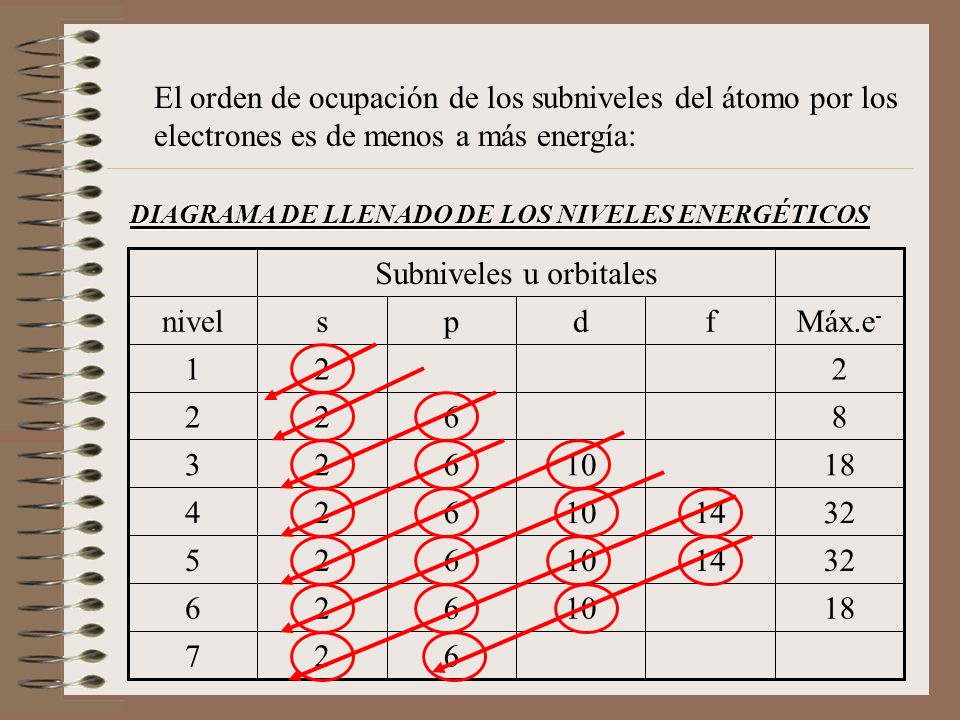
Debes dibujar el ejemplo de ion, el grafico del átomo
y la Tabla: Gases nobles y regla del octeto
ÁTOMO
la partícula más pequeña en que un elemento puede ser dividido sin
perder sus propiedades químicas.
El origen de la palabra átomo
proviene del griego, que significa indivisible. En el momento que se bautizaron
estas partículas se creía que efectivamente no se podían dividir, aunque hoy en
día sabemos que los átomos están formados por partículas aún más pequeñas,
repartidas en las dos partes del átomo, las llamadas partículas subatómicas.
Partes de un átomo

La estructura de un átomo resulta
muy sencilla. Distinguimos dos partes de un átomo: núcleo y corteza.
El núcleo es la parte central de
la estructura del átomo. En la parte del núcleo se encuentran los protones (partículas con carga positiva) y los neutrones (partículas sin carga eléctrica).
En la corteza, la parte exterior
del átomo se encuentran los electrones (partículas con carga eléctrica negativa).
Los protones, neutrones y electrones son las partículas subatómicas que forman
la estructura del átomo. Lo que diferencia a un átomo de otro es la relación
que se establecen entre ellas.
Los electrones, de carga
negativa, son las partículas subatómicas más ligeras. Los protones, de carga positiva, pesan unas 1.836 veces más que
los electrones. Los neutrones, los únicos que no tienen carga eléctrica, pesan
aproximadamente lo mismo que los protones.
Los protones y neutrones se encuentran agrupados en la parte central del
átomo formado el núcleo atómico. Por este motivo también se les llama nucleones.
De este modo, la parte central
del átomo, el núcleo atómico, tiene una carga positiva en la que se concentra
casi toda su masa, mientras que en el escorzo alrededor del núcleo atómico hay un cierto número de electrones, cargados negativamente. La carga total
del núcleo atómico (positiva) es igual a la carga negativa de los
electrones, de modo que la carga eléctrica total del átomo sea neutra.
Modelo de Bohr
Esta descripción de los
electrones orbitando alrededor del núcleo atómico corresponde al sencillo modelo de Bohr. Según la
mecánica cuántica cada partícula tiene una función de onda que ocupa todo el
espacio y los electrones no se encuentran localizados en órbitas aunque la
probabilidad de presencia sea más alta a una cierta distancia del núcleo.
Propiedades de los átomos
Las unidades básicas de la
química son los átomos. Durante las reacciones químicas los átomos se conservan
como tales, no se crean ni se destruyen, pero se organizan de manera diferente
creando enlaces diferentes entre un átomo y otro.
Los átomos se agrupan
formando moléculas y otros tipos de materiales. Cada tipo de molécula es la combinación de un cierto número de átomos
enlazados entre ellos de una manera específica.
Según la composición de cada
átomo se diferencian los distintos elementos químicos representados en la tabla
periódica de los elementos químicos. En esta tabla podemos encontrar el número atómico y el número másico de cada elemento:
·
Número atómico, se representa con
la letra Z, indica la cantidad de protones que presenta un átomo, que es igual
a la de electrones. Todos los átomos con un mismo número de protones pertenecen al mismo elemento y tienen las mismas
propiedades químicas. Por ejemplo todos los átomos con un protón serán de hidrógeno (Z = 1), todos los átomos con
dos protones serán de helio (Z = 2).
·
Número másico, se representa con
la letra A, y hace referencia a la suma de protones y neutrones que contiene el
elemento. Los isótopos son dos átomos con el mismo número de protones, pero diferente número de neutrones. Los isótopos de un mismo elemento, tienen unas propiedades
químicas y físicas muy parecidas entre sí.
GAS NOBLE
Un gas noble es un elemento químico caracterizado porque
su capa de valencia (la
última capa electrónica, es decir, el ultimo nivel de energía) posee 8
electrones (está completa), y por tanto es estable químicamente lo que los hace
muy poco reactivos (no se combinan fácilmente con otros elementos). La única excepción
es el Helio (He) que es estable con 2 electrones en su último nivel de energía.
ELECTRONES DE VALENCIA: son los ubicados en el último
nivel de energía y son los que intervienen en un enlace químico
Los gases
nobles son:
Están ubicados en el grupo (18 ó VlllA) de
la tabla periódica.
Debido a que su reactividad es baja (casi no se mezclan
con otros elementos para formar moléculas y compuestos), también son
denominados gases inertes, aunque en laboratorio, en condiciones
especiales, se han obtenido compuestos con algunos de ellos.
IÓN
La molécula de agua, puede separarse, y formar: un catión
(átomo de Hidrogeno) y un anión (molécula OH: Hidrogeno y Oxigeno)

En física y química, un ión es un átomo o molécula que no tiene una carga
eléctrica neutra, y esto ocurre cuando ganan o pierden electrones. Se denomina
catión un ión con carga eléctrica positiva, y anión un ión con carga eléctrica
negativa.
Los iones cargados negativamente se generan por la
ganancia de electrones y se conocen como aniones (porque son
atraídos por el ánodo), en tanto que los cargados positivamente a raíz de
la pérdida de electrones, generalmente los de la capa más externa, se denominan
cationes (pues estos, contrariamente a los aniones, son atraídos por el
cátodo).
En los aniones, cada electrón del átomo, que es originalmente neutro, está fuertemente retenido por la carga positiva del núcleo; sin embargo y a diferencia de resto de los otros electrones del átomo, en los aniones el electrón adicional no está vinculado al núcleo por fuerzas de Coulomb, lo está por la polarización del átomo neutro. Debido a la adición de electrones, los aniones superan en tamaño al correspondiente átomo neutro.
En los aniones, cada electrón del átomo, que es originalmente neutro, está fuertemente retenido por la carga positiva del núcleo; sin embargo y a diferencia de resto de los otros electrones del átomo, en los aniones el electrón adicional no está vinculado al núcleo por fuerzas de Coulomb, lo está por la polarización del átomo neutro. Debido a la adición de electrones, los aniones superan en tamaño al correspondiente átomo neutro.
A temperatura ambiente, muchos iones de signo opuesto se unen entre sí
fuertemente siguiendo un esquema regular y ordenado que da lugar a la formación
de cristales, como la sal de mesa que es el cloruro de sodio (NaCl). Los
elementos que normalmente presentan mayor facilidad para ionizarse
positivamente, esto es, para perder electrones y así generar cationes (+) son
los metales y halógenos (formadores de sal,
ubicados en el grupo 17 ó VllA) los elementos no metales en general forman aniones (-).
Los gases nobles como el helio o el argón no forman iones. El tamaño de
los cationes es menor que el de los átomos a causa de la pérdida de electrones.
En general, los iones (Cationes y Aniones) son químicamente más
reactivos (tienden a formar compuestos) que los átomos y las moléculas neutras
(que tienen igual cantidad de protones y electrones).
Actividad 1
a) Si analizamos
la distribución electrónica de cada gas noble, observamos que, excepto el
Helio, todos poseen ocho electrones en su último nivel energético. La presencia
de este número de electrones es la clave de su comportamiento. Por lo general,
los gases nobles tienen lleno su último nivel de energía; este hecho les da la
estabilidad que los caracteriza.
b) Cuando se
forma un enlace químico, los átomos ceden, reciben y comparten electrones para
adquirir la configuración de gas noble más cercano dentro del sistema
periódico, con ocho electrones en su último nivel de energía.


Actividad 2
Tabla: Gases
nobles y regla del octeto
Símbolo Químico
|
Distribución electrónica
|
Niveles
de energía
|
Electrones
de valencia
|
Recibe, cede o comparte e
|
Estructura
del gas noble
|
O
|
1s2
2s2 2p4
|
2
|
6
|
Recibe
|
He
|
C
|
1s2
2s2 2p2
|
2
|
4
|
Comparte
|
He
|
Al
|
1s2
2s2 2p6 3s2 3p1
|
3
|
3
|
Cede
|
Ne
|
P
|
1s2
2s2 2p6 3s2 3p3
|
3
|
5
|
Recibe
|
Ne
|
Cl
|
1s2
2s2 2p6 3s2 3p5
|
3
|
7
|
Recibe
|
Ne
|
Na
|
1s2
2s2 2p6 3s1
|
3
|
1
|
Cede
|
Ne
|
Ca
|
1s2
2s2 2p6 3s2 3p6 4s2
|
4
|
2
|
Cede
|
Ar
|
Ar
|
1s2
2s2 2p6 3s2 3p6
|
3
|
8
|
EL ENLACE IONICO
Recordemos que los átomos
están formados por 2 partes: el núcleo(donde se encuentran los protones y los
neutrones) y la periferia (donde orbitan los electrones), los protones
tienen carga positiva (+), los neutrones no tienen carga y los electrones que tienen carga negativa (-) son
los que entran en juego en los enlaces, por lo tanto son los únicos que nos interesan. Están girando en órbitas alrededor
del núcleo del átomo, llamadas orbitales o capas.

¿Cómo se unen los átomos? Una de las formas de unión es formando enlaces iónicos que son los que explicaremos aquí.
Los enlaces químicos son las fuerzas que mantienen unidos a los átomos.
Cuando dos átomos se unen, ceden, aceptan o comparten electrones, pero solo los llamados electrones de valencia pueden hacer esto. Los electrones de valencia son los que se encuentran en la última capa del átomo y son los únicos que están dispuestos a compartirse con otro átomo.
Cuando dos átomos se unen siempre cumplen la llamada regla del octeto.
Regla del Octeto
La regla del octeto, también llamada ley de Lewis, dice que todos los átomos de los elementos del sistema periódico, tienden a completar sus últimos niveles de energía con una cantidad de 8 electrones.
Son los electrones de la última capa, los más alejados del núcleo, los que tienden a completarse hasta ser un total de 8 electrones y para ello compartirán electrones con otro átomo.
Los gases nobles, (ubicados en el grupo VIIIA, o 18) son muy poco o no reactivos, por tener 8 electrones en su última capa (electrones de valencia)y no admiten más.
Esta combinación se puede hacer de varias formas, una de ellas es el enlace iónico.

¿Cómo se unen los átomos? Una de las formas de unión es formando enlaces iónicos que son los que explicaremos aquí.
Los enlaces químicos son las fuerzas que mantienen unidos a los átomos.
Cuando dos átomos se unen, ceden, aceptan o comparten electrones, pero solo los llamados electrones de valencia pueden hacer esto. Los electrones de valencia son los que se encuentran en la última capa del átomo y son los únicos que están dispuestos a compartirse con otro átomo.
Cuando dos átomos se unen siempre cumplen la llamada regla del octeto.
Regla del Octeto
La regla del octeto, también llamada ley de Lewis, dice que todos los átomos de los elementos del sistema periódico, tienden a completar sus últimos niveles de energía con una cantidad de 8 electrones.
Son los electrones de la última capa, los más alejados del núcleo, los que tienden a completarse hasta ser un total de 8 electrones y para ello compartirán electrones con otro átomo.
Los gases nobles, (ubicados en el grupo VIIIA, o 18) son muy poco o no reactivos, por tener 8 electrones en su última capa (electrones de valencia)y no admiten más.
Esta combinación se puede hacer de varias formas, una de ellas es el enlace iónico.
Muy Importante: "Los enlaces iónicos están formados por un metal
más un No metal".


Pero...antes de seguir,
explicaremos que son los cationes y lo aniones, muy importante para entender
los enlaces iónicos.
Los electrones y los protones de un átomo tienen la misma cantidad de carga eléctrica, pero en sentido contrario) los electrones negativa y los protones positiva.
Los átomos tienen carga neutra (sin carga) ya que tienen tantos electrones con carga negativa, como protones con carga positiva, por lo que se anula la negativa de los electrones con la positiva de los protones.
Pero si a un átomo le quitamos un electrón, lógicamente quedará con carga positiva (tiene 1 protón más que el número de electrones). Si le añadimos un electrón quedará con carga negativa. Según lo dicho tenemos:
Cationes: átomos con carga positiva. Se forman cuando ceden un electrón suyo a otro átomo (pierden un electrón).
Aniones: átomos con carga negativa, ya que cogen un electrón de otro átomo (aumentan en un electrón).
Sigamos con los enlaces iónicos formados por Metal + No metal = enlaces ionicos.
Ten siempre en cuenta los siguiente: "Los metales ceden electrones formando cationes, los no metales aceptan electrones formando aniones".
Recuerda que una carga eléctrica negativa y otra positiva se atraen. ¿Qué pasará con el catión (carga positiva) y el anión (carga negativa) formado por los dos átomos al encontrarse?. Pues que se atraen y forman el enlace iónico.
Una vez hecho el enlace, este no forma moléculas verdaderas, los átomos solo están unidos por fuerzas eléctricas. El resultado son iones positivos y negativos que se atraen entre sí, llamados enlaces iónicos, pero no moléculas verdaderas.
En los enlaces covalentes si se forman moléculas, pero no es el tema que tratamos aquí.
Los electrones y los protones de un átomo tienen la misma cantidad de carga eléctrica, pero en sentido contrario) los electrones negativa y los protones positiva.
Los átomos tienen carga neutra (sin carga) ya que tienen tantos electrones con carga negativa, como protones con carga positiva, por lo que se anula la negativa de los electrones con la positiva de los protones.
Pero si a un átomo le quitamos un electrón, lógicamente quedará con carga positiva (tiene 1 protón más que el número de electrones). Si le añadimos un electrón quedará con carga negativa. Según lo dicho tenemos:
Cationes: átomos con carga positiva. Se forman cuando ceden un electrón suyo a otro átomo (pierden un electrón).
Aniones: átomos con carga negativa, ya que cogen un electrón de otro átomo (aumentan en un electrón).
Sigamos con los enlaces iónicos formados por Metal + No metal = enlaces ionicos.
Ten siempre en cuenta los siguiente: "Los metales ceden electrones formando cationes, los no metales aceptan electrones formando aniones".
Recuerda que una carga eléctrica negativa y otra positiva se atraen. ¿Qué pasará con el catión (carga positiva) y el anión (carga negativa) formado por los dos átomos al encontrarse?. Pues que se atraen y forman el enlace iónico.
Una vez hecho el enlace, este no forma moléculas verdaderas, los átomos solo están unidos por fuerzas eléctricas. El resultado son iones positivos y negativos que se atraen entre sí, llamados enlaces iónicos, pero no moléculas verdaderas.
En los enlaces covalentes si se forman moléculas, pero no es el tema que tratamos aquí.
Ejemplos de Enlaces Ionicos
Veamos un primer ejemplo:

Fíjate el Li (litio) tiene en su última capa (capa S) un electrón, el F (Flúor) tiene en su última capa (capa p) 5 electrones. Se unen mediante un enlace iónico cediendo el litio el único electrón de su última capa al flúor, con lo que el flúor tiene ahora 6 átomos en su última capa (más cerca de los 8 ideales). Más abajo tienes un enlace para saber los electrones en cada capa llamado configuración electrónica.
El Litio es el metal, cede un electrón y se convierte en un catión.
El Flúor es el No Metal, coge un electrón y se convierte en un anión.
Los dos ahora quedan unidos por la fuerza eléctrica, una positiva (la del catión) y otra negativa (la del anión), formando un enlace iónico.
Veamos ahora el caso del cloruro sódico, la sal común. El sodio (Na) cede un electrón, y el cloro (Cl) lo coge. Se expresa de la siguiente fórmula:
Na - 1 e- ---> Na+ (un catión de sodio)
Cl + 1 e- ---> Cl- (un anión de cloro)
Lógicamente para saber hacer enlaces iónicos hay que saber el número de electrones que tiene cada átomo en su última capa, a esto se le llama la configuración electrónica de cada elemento, que no es ni mas ni menos como se distribuyen los electrones en las diferentes órbitas del átomo. Eso lo puedes aprender aquí: Configuraciones electrónicas.
Como ves si sabemos la configuración electrónica de los elementos de la tabla periódica, es muy fácil hacer sus enlaces iónicos.
Más enlaces iónicos son estos: NaCl (cloruro de sodio), KCl (cloruro de sodio), KI (ioduro de potasio), CaCl2 (cloruro de calcio), FeO (óxido de hierro (II)), MnO2 (manganesa), Li3N (nitruro de litio), CaC2 (acetiluro de calcio), Ca3P2 (fosfuro de calcio) y AgCl (cloruro de plata).

Fíjate el Li (litio) tiene en su última capa (capa S) un electrón, el F (Flúor) tiene en su última capa (capa p) 5 electrones. Se unen mediante un enlace iónico cediendo el litio el único electrón de su última capa al flúor, con lo que el flúor tiene ahora 6 átomos en su última capa (más cerca de los 8 ideales). Más abajo tienes un enlace para saber los electrones en cada capa llamado configuración electrónica.
El Litio es el metal, cede un electrón y se convierte en un catión.
El Flúor es el No Metal, coge un electrón y se convierte en un anión.
Los dos ahora quedan unidos por la fuerza eléctrica, una positiva (la del catión) y otra negativa (la del anión), formando un enlace iónico.
Veamos ahora el caso del cloruro sódico, la sal común. El sodio (Na) cede un electrón, y el cloro (Cl) lo coge. Se expresa de la siguiente fórmula:
Na - 1 e- ---> Na+ (un catión de sodio)
Cl + 1 e- ---> Cl- (un anión de cloro)
Lógicamente para saber hacer enlaces iónicos hay que saber el número de electrones que tiene cada átomo en su última capa, a esto se le llama la configuración electrónica de cada elemento, que no es ni mas ni menos como se distribuyen los electrones en las diferentes órbitas del átomo. Eso lo puedes aprender aquí: Configuraciones electrónicas.
Como ves si sabemos la configuración electrónica de los elementos de la tabla periódica, es muy fácil hacer sus enlaces iónicos.
Más enlaces iónicos son estos: NaCl (cloruro de sodio), KCl (cloruro de sodio), KI (ioduro de potasio), CaCl2 (cloruro de calcio), FeO (óxido de hierro (II)), MnO2 (manganesa), Li3N (nitruro de litio), CaC2 (acetiluro de calcio), Ca3P2 (fosfuro de calcio) y AgCl (cloruro de plata).
Enlace Covalente
Los enlace
covalentes están formados por átomos
NO METALICOS.
Recuerda enlace (átomos que comparten electrones y por lo tanto están
enlazados)
Los átomos No metálicos suelen tener muchos electrones girando en su última órbita (llamados electrones de valencia) por lo que tienden a ganar (coger) electrones de otro átomo en lugar de cederlos para tener los 8 electrones de la regla del octeto y tener la estabilidad de los gases nobles (tener 8 electrones de valencia). El problema es que como los dos átomos están en este caso, los dos son no metales, ninguno de los dos querrá ceder sus electrones al otro.
¿Qué implica esto? pues que estos átomo, los no metales, como no quieren desprenderse de electrones, al encontrarse o unirse, lo que harán será compartir electrones de su última capa, en lugar de ceder o ganar electrones, que sería el caso de los enlaces iónicos.
Conclusión: los átomos no metálicos no pueden ceder ni ganar electrones entre si, si no que los comparten.
"Los enlaces covalentes se forman entre dos No Metales y compartiendo electrones de valencia".
Cuando se unen dos átomos no metálicos, los electrones que comparten los mantienen unidos y forman parte de los dos átomos, formando así una molécula (varios átomos unidos). Una vez unidos, los dos átomos adquieren la estructura de los gases nobles con 8 átomos.
Pueden estar unidos por enlaces sencillos, dobles o triples, dependiendo de los electrones que compartan en la unión.
Formación de los Enlaces Covalentes
Veamos un ejemplo de formación de enlaces covalentes.
El Cloro es un NO metal. El cloro en estado natural se presenta en Cl2, es decir una molécula de cloro de 2 átomos. Los dos átomos de cloro están unidos mediante un enlace covalente.
Los átomos No metálicos suelen tener muchos electrones girando en su última órbita (llamados electrones de valencia) por lo que tienden a ganar (coger) electrones de otro átomo en lugar de cederlos para tener los 8 electrones de la regla del octeto y tener la estabilidad de los gases nobles (tener 8 electrones de valencia). El problema es que como los dos átomos están en este caso, los dos son no metales, ninguno de los dos querrá ceder sus electrones al otro.
¿Qué implica esto? pues que estos átomo, los no metales, como no quieren desprenderse de electrones, al encontrarse o unirse, lo que harán será compartir electrones de su última capa, en lugar de ceder o ganar electrones, que sería el caso de los enlaces iónicos.
Conclusión: los átomos no metálicos no pueden ceder ni ganar electrones entre si, si no que los comparten.
"Los enlaces covalentes se forman entre dos No Metales y compartiendo electrones de valencia".
Cuando se unen dos átomos no metálicos, los electrones que comparten los mantienen unidos y forman parte de los dos átomos, formando así una molécula (varios átomos unidos). Una vez unidos, los dos átomos adquieren la estructura de los gases nobles con 8 átomos.
Pueden estar unidos por enlaces sencillos, dobles o triples, dependiendo de los electrones que compartan en la unión.
Formación de los Enlaces Covalentes
Veamos un ejemplo de formación de enlaces covalentes.
El Cloro es un NO metal. El cloro en estado natural se presenta en Cl2, es decir una molécula de cloro de 2 átomos. Los dos átomos de cloro están unidos mediante un enlace covalente.
El cloro tiene 7 electrones en su última capa, por lo tanto si comparten uno de estos electrones cada uno , en la molécula ya tendrían 8 electrones cada uno.
Perfecto han formado una molécula con dos átomos muy estables. Este enlace solo necesita compartir un electrón cada uno para formar el octeto.
Aquí lo puedes ver:

Otro caso es el de la molécula de oxígeno O2. Cada átomo de oxígeno tiene 6 electrones de valencia, con lo que tendrán que compartir 2 electrones cada uno para llegar al octeto.
Los enlaces covalentes pueden compartir 1, 2 o 3 electrones de valencia. Se llaman enlaces simples, dobles o triples. Aquí tienes un ejemplo de cada uno de ellos: Cl2, O2 y N2.

Normalmente estos enlaces de forma escrita se expresan poniendo un redondelito por cada electrón de valencia de cada átomo y una rayita por cada uno de los electrones compartidos en el enlace. Mira estos dos ejemplos:

El F2 comparten 1 electrón, pues una rayita, el O2 comparten 2 electrones, pues 2 rayitas. El primero es simple y el segundo doble. Ya sabes existen hasta enlaces triples.
La pregunta es ¿Cómo sé cuantos electrones de valencia tiene un átomo cualquiera? Eso se llama configuración electrónica del átomo y puedes saberlo si vas al siguiente enlace: Configuración Electrónica. Otra forma sencilla es conocer las familias de la tabla periódica, y también sabrás los electrones de valencia.
Si sabemos la configuración electrónica de los no metales que forman el enlace covalente, ves que es muy fácil ver como es el enlace covalente. En la tabla periódica de los elementos a veces también viene especificado el número de electrones de valencia de cada átomo.
Vamos a ponerte un ejercicio, tranquilo con la solución, poco a poco te la diremos.
¿Determina en las siguientes uniones covalentes si el enlace que se forma es sencillo doble o triple?
N2 , I2 , O2 , Br2
Solución:
N2= El nitrógeno tiene 5 electrones de valencia, teniendo en cuenta que todos los átomos buscan tener el estado de valencia mas estable que es el octeto, este formará un triple enlace.
I2= Un enlace sencillo porque tienen 7 electrones de valencia.
H2=Enlace sencillo, el hidrogeno es una excepción a la regla del octeto y este solo busca tener dos electrones en su ultimo nivel de energía.
O2= Un doble enlace ya que tiene dos electrones de valencia.
Br2=Forma un enlace sencillo ya que tiene 7 electrones de valencia.
Hasta aquí los enlaces covalentes más sencillos, pero los hay un poco más complejos.
Veamos un enlace de 3 no metales el CO2 o dióxido de carbono. Tiene la siguiente expresión O=C=O. ¿Por qué?
El oxígeno tiene 6 enlaces de valencia, y el cloro 4. ¿Cómo forman el enlace covalente? Pues el cloro comparte su 4 electrones de valencia con los otros dos átomos de oxígeno, así los átomos de oxígeno tienen 8 electrones. Esto es algo más difícil.
Este tipo de enlaces se llaman enlaces covalentes coordinados o dativos: Es un enlace covalente en el que el par de electrones que se comparte es aportado por un solo átomo ( en nuestro caso el carbono). A los compuestos con este tipo de enlace se llaman complejos.
Para formar este tipo de enlaces hay que saber la llamada estructura de lewis que es una interpretación de la covalencia.
La electronegatividad es la capacidad para traer los electrones. En la tabla periódica de arriba hacia abajo en un grupo la electronegatividad desciende mientras que en un periodo de izquierda a derecha la electronegatividad aumenta. Además existe una tabla de electronegatividad con los números concretos de electronegatividad de cada átomo.

Otro ejemplo es la molécula de agua H2O. Un átomo de oxígeno tiene seis electrones en la última capa, por lo que le faltan dos para completarla. Es por ello que se une con dos átomos de hidrógeno, cada uno de los cuales aporta su único electrón. El resultado es que se forma una molécula de agua en la que existen dos enlaces covalentes oxígeno-hidrógeno.
Fíjate en este imagen:

Este es un enlace covalente triple, formado por 3 átomos. Como ves en este caso hay un átomo llamado central, en este caso el carbono. Este átomo tiene 4 electrones de valencia que compartirá uno con cada átomo del hidrógeno para tener 8 electrones, formando una nube de electrones que comparte la molécula.
Ejemplos de Enlaces Covalentes
Molécula de Agua (H2O), Amoniaco (NH3), H2 (gas dihidrógeno), O2 (gas oxígeno), Cl2 (gas cloro), Br2 (bromo elemental), N2 (gas nitrógeno), CH4 (metano), C2H6 (etano), S8 (azufre rómbico), P4 (fósforo blanco) y NF3 (fluoruro de nitrógeno).
Características de los Enlaces Covalentes
- Los compuestos covalentes pueden presentarse en cualquier estado de agregación física de la materia: solido, liquido o gaseoso.
- Son malos conductores del calor y la electricidad.
- Tienen punto de fusión y ebullición relativamente bajos.
- Son solubles en solventes polares como benceno, tetracloruro de carbono, etc., e insolubles en solventes polares como el agua.
Suscribirse a:
Comentarios (Atom)
